Diketahui:
q = -600 kJ (karena sistem melepas kalor, maka q bertanda negatif)
w = -98 kJ (karena sistem melakukan kerja, maka w bertanda negatif)
Ditanya:
Berapa nilai energi dalam (ΔE) dalam proses pembentukan asam sulfat tersebut?
Dijawab:
Energi dalam tidak bisa diukur secara langsung, tetapi dapat diketahui besar perubahan dari suatu proses reaksi yang terjadi. Rumus perubahan energi dalam sebagai berikut.
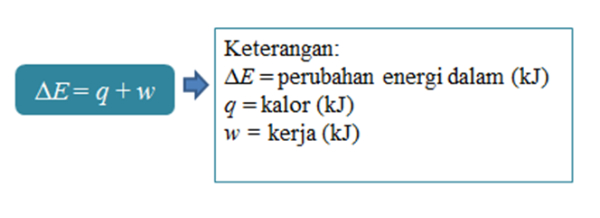
ΔE=q+w
=−600 kJ + (−98) kJ
=−600 kJ − 98 kJ
=−698 kJ
Jadi, perubahan energi dalam pada reaksi tersebut adalah -698 kJ.