Diketahui:
Energi ikatan:
- C−H = +413 kJ/mol
- C−C = +348 kJ/mol
- H−Cl = +431 kJ/mol
- H−H = +436 kJ/mol
Ditanya:
Berapa nilai energi ikatan rata-rata C−Cl?
Dijawab:
Pada penentuan perubahan entalpi reaksi tersebut, maka harus digambar strukturnya terlebih dahulu.
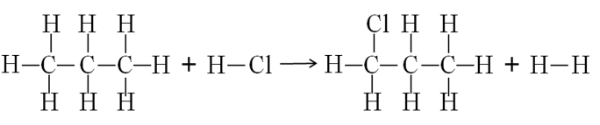
Dalam persamaan kimia pada dasarnya terdapat dua proses, yaitu pemutusan ikatan dan penggabungan ikatan. Dimulai dari pemutusan ikatan antaratom dari senyawa-senyawa di ruas kiri (reaktan), kemudian terjadi penggabungan ikatan kembali antaratom sehingga membentuk susunan baru, yaitu senyawa di ruas kanan (produk). Berdasarkan ulasan tersebut dapat dirumuskan sebagai berikut.
ΔH=∑Energi ikatan zat pereaksi−∑Energi ikatan zat hasil reaksi
80={8(C−H)+2(C−C)+H−Cl}−{7(C−H)+2(C−C)+C−Cl+H−H}
80={8(413)+2(348)+431}−{7(413)+2(348)+C−Cl+436}
80={3.304+696+431}−{2.891+696+C−Cl+ 436}
80=4.431−(4.023+C−Cl)
80=408−C−Cl
C−Cl=408−80
C−Cl=328 kJ.mol−1
Jadi, nilai energi ikatan rata-rata C−Cl adalah +328 kJ/mol.