Diketahui:
∆T = 5 0C = 5 K
Kapasitas kalor kalorimeter (C) = 958 J/K
Kalor jenis (c) = 4,2 J/gram.K
Massa air = 1.000 gram
Massa propana = 2,8 gram
Ar: C = 12, H = 1, O = 16
Ditanya:
Entalpi pembakaran propana?
Dijawab:
Kalor yang dilepas selama reaksi sama dengan kalor yang diserap oleh air dalam kalorimeter dan oleh kalorimeter, maka dapat dirumuskan sebagai berikut:
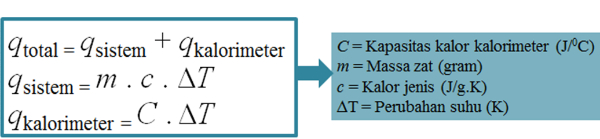
qsistem=m×c×ΔT
=1.000 gram×4,2 J.gram−1.K−1×5 K
=21.000 J
qkalorimeter=C×ΔT
=958 J.K−1×5 K
=4.790 J
qtotal=qsistem+qkalorimeter
=21.000 J+4.790 J
=25.790 J
=25,79 kJ
- Menghitung mol propana yang dibakar
Jumlah propana yang dibakar adalah 2,8 gram, maka jumlah mol-nya adalah
mol=MrMassa
=562,8 gram
=0,05 mol
- Menghitung kalor pembakaran dalam kJ/mol
q=0,05 mol25,79 kJ=515,8 kJ.mol−1
- Menghitung entalpi pembakaran
ΔH=−q=−515,8 kJ.mol−1
Jadi, nilai perubahan entalpi pembakaran propana adalah -515,8 kJ/mol.