Diketahui:
2CuCl(s)⟶2Cu(s)+Cl2(g) ΔH=+274,4 kJ.mol−1
2CuCl(s)+Cl2(g)⟶2CuCl2(s) ΔH=−165,8 kJ.mol−1
Massa CuCl2 = 27,0 gram
Ar: Cu = 64, Cl = 35,5
Ditanya:
Berapa nilai perubahan entalpi untuk reaksi pembentukan 27,0 gram CuCl2?
Dijawab:
- Menulis persamaan reaksi yang ditanyakan pada soal dan menyetarakan
Reaksi pembentukan CuCl2
Cu(s)+Cl2(g)⟶CuCl2(s)
- Pembentukan persamaan termokimia pada soal dari persamaan termokimia yang diketahui
a. Logam Cu pada soal sebagai reaktan dengan koefisien 1, sedangkan pada persamaan termokimia yang diketahui sebagai produk dengan koefisien 2. Oleh karena itu, reaksi dibalik dan koefisien dibagi 2, sehingga nilai ΔH akan berganti tanda dan dibagi 2 juga.
Cu(s)+21Cl2(g)⟶CuCl(s) ΔH=−137,2 kJ.mol−1
b. Senyawa CuCl2 pada soal sebagai produk dengan koefisien 1, sedangkan pada persamaan termokimia yang diketahui sebagai produk dengan koefisien 2. Oleh karena itu, reaksinya tetap dan koefisien dibagi 2, sehingga nilai ΔH juga dibagi 2.
CuCl(s)+21Cl2(g)⟶CuCl2(s) ΔH=−82,9 kJ.mol−1
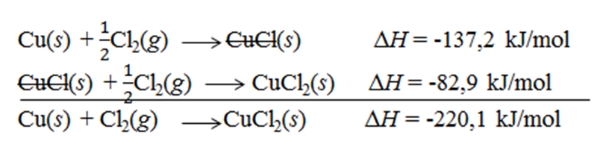
Mr CuCl = 135
mol=molMassa
=13527,0
=0,2 mol
- Menghitung perubahan entalpi
ΔH=mol×(−220,1 kJ.mol−1)
=0,2 mol×(−220,1 kJ.mol−1)
=−44,02 kJ
Jadi, perubahan entalpi untuk reaksi pembentukan 27,0 gram CuCl2 adalah -44,02 kJ.