Bank Soal Kimia SMA Entalpi dan Nilai Perubahan Entalpi
Soal
Soal Populer Hari Ini
(i) 24816= 321616:232
(ii) 8127:93= 24327:279:81
(iii) ((-98)7)6:(-34)5(-12)= 3652
Matematika
Level 7
Bilangan
Bilangan dan Operasi Hitung Bilangan
Bilangan Berpangkat
Keliling sebuah persegi panjang sama dengan keliling sebuah persegi. Lebar persegi panjang lebih pendek 8 cm daripada panjangnya. Jika sisi persegi dapat diketahui dari persamaan: 5(s + 16) = 180, di mana s adalah sisi persegi, maka pernyataan berikut yang benar adalah ...
Matematika
Level 7
Aljabar
Persamaan dan Pertidaksamaan Linear Satu Variabel
Persamaan Linear Satu Variabel (PLSV)
Kelas VII
Kurikulum 2013
K13
Matematika
Perhatikan gambar berikut.

Bagian yang diarsir menunjukkan …
Matematika
Level 7
Bilangan
Himpunan
Konsep dan Macam-Macam Himpunan
Perhatikan gambar berikut!
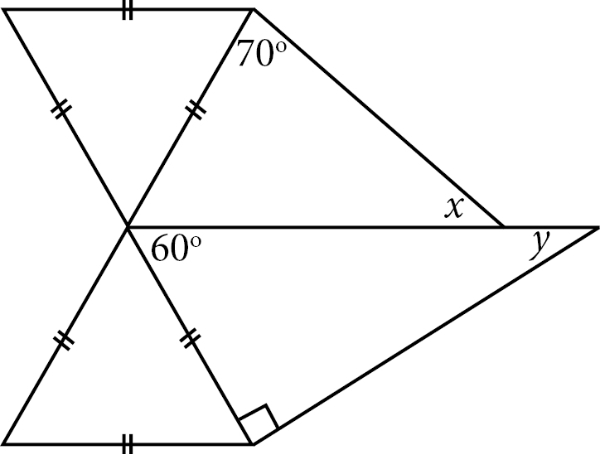
Nilai dari adalah ....
Matematika
Level 7
Geometri
Garis dan Sudut
Hubungan Antar Sudut
Kelas VII
Kurikulum 2013
K13
Matematika
Surat dinas adalah surat ....
Bahasa Indonesia
Level 7
Menulis
Surat Pribadi dan Surat Dinas
Ciri Surat Pribadi dan Surat Dinas
KD3.11
Kelas VII
Kurikulum 2013
K13
Bahasa Indonesia
Bentuk paling sederhana dari
....
Matematika
Level 7
Aljabar
Bentuk Aljabar
Operasi Pecahan Bentuk Aljabar
Kelas VII
Kurikulum 2013
K13
Matematika
Pernyataan berikut yang termasuk ciri-ciri teks deskripsi adalah ....
Bahasa Indonesia
Level 7
Menulis
Teks Deskripsi
Ciri dan Tujuan Teks Deskripsi
Perhatikan kutipan berikut!
Badan Zafran kurus, sekurus kapur tulis. Kalau ngeliat potongan rambut yang gondrong samping dan depan aja, pasti langsung ngingetin sama potongan rambut Liam Gallagher, vokalis Oasis. Baju sehari-harinya adalah baju modis dari distro terdekat yang bisa dicapai. Di antara modisnya, Zafran punya kelakuan yang berantakan, yang katanya "standar seniman".
Selain nama-nama vokalis besar tadi, ternyata Zafran adalah pengagum setia Erie Susan, penyanyi dangdut yang tinggi semampai, tapi gengnya nggak pernah ngetawain dia terang-terangan karena nggak enak—soalnya dia ngefans banget, (beneran).
Zafran adalah orang yang akan bilang apa aja yang dia mau bilang, agak saklek tapi kocak karena kalau dia udah ketemu sama Riani, kayaknya bisa bikin orang bingung apa yang lagi mereka obrolin. Pernah ada yang ajaib dari Zafran. Sehabis nonton bareng filmnya Brad Pitt dan Eric Bana, Troy, Zafran percaya bahwa dia sebenarnya mempunyai keturunan Achilles dalam darahnya. Fakta ini muncul karena menurut dia, "Gue itu orangnya pasti lain dari orang kebanyakan," Semua teman pun setuju sambil nahan muntah.
(Dikutip dari novel berjudul "5cm" karya Donny Dhirgantoro)
Kutipan tersebut termasuk dalam kategori fiksi karena ....
Bahasa Indonesia
Level 7
Menulis
Buku Fiksi dan Nonfiksi
Unsur Pembangun Buku Fiksi dan Nonfiksi
KD3.9
Kelas VII
Kurikulum 2013
K13
Bahasa Indonesia
Diagram batang di bawah ini menunjukkan data hasil produksi padi (ton) selama 2010 - 2014..
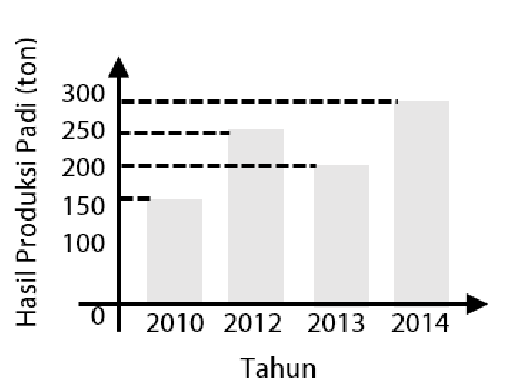
Selisih hasil produksi pada tahun 2014 dengan 2013 adalah ... ton.
Matematika
Level 7
Statistika
Penyajian dan Pengolahan Data
Konsep dan Pengumpulan Data
Kelas VII
Kurikulum 2013
K13
Matematika
Read the text below and answer the question.

picture: freepik.com
My name is Kirana. I am an artist. I draw everyday. I work in my gallery at Jalan Laksa Adisucipto, Yogyakarta. I usually draw scenery and famous people.
What does Kirana do? She is ....
Bahasa Inggris
Level 7
Bahasa Inggris
Describing oneself
Self Introduction
Kelas VII
Kurikulum 2013
K13
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
(i) 24816= 321616:232
(ii) 8127:93= 24327:279:81
(iii) ((-98)7)6:(-34)5(-12)= 3652
Keliling sebuah persegi panjang sama dengan keliling sebuah persegi. Lebar persegi panjang lebih pendek 8 cm daripada panjangnya. Jika sisi persegi dapat diketahui dari persamaan: 5(s + 16) = 180, di mana s adalah sisi persegi, maka pernyataan berikut yang benar adalah ...
Perhatikan gambar berikut.
Bagian yang diarsir menunjukkan …
Perhatikan gambar berikut!
Nilai dari adalah ....
Surat dinas adalah surat ....
Bentuk paling sederhana dari
....
Pernyataan berikut yang termasuk ciri-ciri teks deskripsi adalah ....
Perhatikan kutipan berikut!
Badan Zafran kurus, sekurus kapur tulis. Kalau ngeliat potongan rambut yang gondrong samping dan depan aja, pasti langsung ngingetin sama potongan rambut Liam Gallagher, vokalis Oasis. Baju sehari-harinya adalah baju modis dari distro terdekat yang bisa dicapai. Di antara modisnya, Zafran punya kelakuan yang berantakan, yang katanya "standar seniman".
Selain nama-nama vokalis besar tadi, ternyata Zafran adalah pengagum setia Erie Susan, penyanyi dangdut yang tinggi semampai, tapi gengnya nggak pernah ngetawain dia terang-terangan karena nggak enak—soalnya dia ngefans banget, (beneran).
Zafran adalah orang yang akan bilang apa aja yang dia mau bilang, agak saklek tapi kocak karena kalau dia udah ketemu sama Riani, kayaknya bisa bikin orang bingung apa yang lagi mereka obrolin. Pernah ada yang ajaib dari Zafran. Sehabis nonton bareng filmnya Brad Pitt dan Eric Bana, Troy, Zafran percaya bahwa dia sebenarnya mempunyai keturunan Achilles dalam darahnya. Fakta ini muncul karena menurut dia, "Gue itu orangnya pasti lain dari orang kebanyakan," Semua teman pun setuju sambil nahan muntah.
(Dikutip dari novel berjudul "5cm" karya Donny Dhirgantoro)
Kutipan tersebut termasuk dalam kategori fiksi karena ....
Diagram batang di bawah ini menunjukkan data hasil produksi padi (ton) selama 2010 - 2014..
Selisih hasil produksi pada tahun 2014 dengan 2013 adalah ... ton.
Read the text below and answer the question.
picture: freepik.com
My name is Kirana. I am an artist. I draw everyday. I work in my gallery at Jalan Laksa Adisucipto, Yogyakarta. I usually draw scenery and famous people.
What does Kirana do? She is ....







