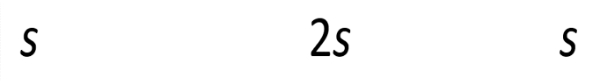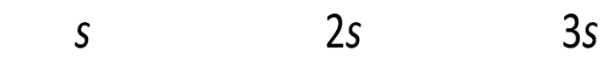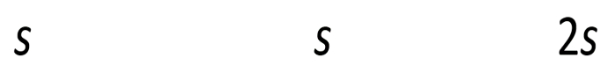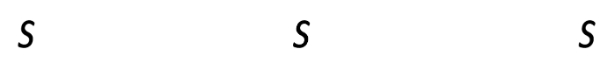Kelarutan adalah jumlah maksimum zat yang dapat dilarutkan dalam sejumlah pelarut. Kelarutan dapat dinyatakan dalam dua jenis.
- Untuk zat yang mudah larut: dinyatakan dalam gram/100 gram air.
- Untuk zat yang sukar larut: dinyatakan dalam mol/L atau kemolaran.
Diketahui:
Ksp Ni(OH)2 = 2,3 × 10-16
pH larutan A = 12
pH larutan B = 11
pH larutan C = 10
pH larutan D = 9
pH larutan E = 8
Ditanya: Larutan yang paling baik untuk melarutkan Ni(OH)2?
Dijawab:
Reaksi pelarutan yang terjadi pada Ni(OH)2 adalah sebagai berikut.
Ni(OH)2(s) ⇌ 2OH-(aq) + Ni2+(aq)
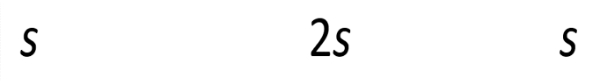
Larutan A (pH = 12)
pOH=14−pH
=14−12
=2
[OH−]=10−pOH=10−2
Konsentrasi ion-ion penyusunnya menjadi sebagai berikut:
[OH−]=2s+10−2≈10−2
[Ni2+]=s
Ksp Ni(OH)2=[OH−]2[Ni2+]
2,3×10−16=(10−2)2(s)
s=10−42,3×10−16
s=2,3×10−12
Larutan B (pH = 11)
pOH=14−pH
=14−11
=3
[OH−]=10−pOH=10−3
Konsentrasi ion-ion penyusunnya menjadi sebagai berikut:
[OH−]=2s+10−3≈10−3
[Ni2+]=s
Ksp Ni(OH)2=[OH−]2[Ni2+]
2,3×10−16=(10−3)2(s)
s=10−62,3×10−16
s=2,3×10−10
Larutan C (pH = 10)
pOH=14−pH
=14−10
=4
[OH−]=10−pOH=10−4
Konsentrasi ion-ion penyusunnya menjadi sebagai berikut:
[OH−]=2s+10−4≈10−4
[Ni2+]=s
Ksp Ni(OH)2=[OH−]2[Ni2+]
2,3×10−16=(10−4)2(s)
s=10−82,3×10−16
s=2,3×10−8
Larutan D (pH = 9)
pOH=14−pH
=14−9
=5
[OH−]=10−pOH=10−5
Konsentrasi ion-ion penyusunnya menjadi sebagai berikut:
[OH−]=2s+10−5≈10−5
[Ni2+]=s
Ksp Ni(OH)2=[OH−]2[Ni2+]
2,3×10−16=(10−5)2(s)
s=10−102,3×10−16
s=2,3×10−6
Larutan E (pH = 8)
pOH=14−pH
=14−8
=6
[OH−]=10−pOH=10−6
Konsentrasi ion-ion penyusunnya menjadi sebagai berikut:
[OH−]=2s+10−6≈10−6
[Ni2+]=s
Ksp Ni(OH)2=[OH−]2[Ni2+]
2,3×10−16=(10−6)2(s)
s=10−122,3×10−16
s=2,3×10−4
Kelarutan Ni(OH)2 memiliki nilai terbesar ketika berada dalam larutan E dengan pH 8 sehingga larutan yang akan melarutkan Ni(OH)2 paling baik adalah larutan E (pH = 8).